
A NAGYOBB TŰRŐKÉPESSÉG a szárazsággal, a sós talajokkal szemben, a megnövelt ellenállóképesség a rovarokkal és a gyomirtókkal szemben olyan tulajdonságok, amelyeket a géntervezők be szeretnének juttatni a növényekbe. A vírusokkal szembeni ellenállóképesség egy kulcsfontosságú cél, figyelembe véve a vírusfertőzések által okozott hatalmas méretű gazdasági károkat. Délkelet-Ázsiában például egyetlen vírusos rizsbetegség, a tungro, évente 1,5 milliárd dolláros veszteségeket okoz. A probléma egyik lehetséges megoldása az lenne, hogy a növényi sejtekbe egy gént vigyenek be, amely a vírus DNS-t [még éretlen állapotban] beburkolja. Ezt a módszert alkalmazva a dohányra és a dohánymozaik-vírusra (TMV - Tobacco Mosaic Virus), a növény ellenállóvá válik a vírus által okozott fertőzéssel szemben. A TMV-vel beoltott, [genetikailag módosított] növények nem veszítenek terméshozamukból, míg a módosítatlan növények terméshozama 23-69 százalékkal csökken.
A másik ok arra, hogy a növényekbe új géneket vigyünk be, a tápérték növelése. Az emberi szervezet a fehérjék felépítésében résztvevő húszféle aminosavnak csupán a felét képes előállítani. Mivel a másik tízet táplálék révén kell megszereznünk, étrendünk magába kell foglaljon olyan fehérjéket [esszenciális aminosavakat], amelyek megfelelő mennyiségben tartalmazzák ezeket a létfontosságú anyagokat. Nagy a veszélye annak, hogy ez nem történik meg, különösen a világnak azokon a részein, ahol csak egyetlen növény képezi az alapétrend legnagyobb részét. Például Afrika és Dél-Amerika egyes részein ahol a sok hüvelyes zöldség fehérjéi nagyon kevés kéntartalmú aminosavat tartalmaznak. Az ilyen típusú hiányosságok helyrehozhatók olyan módon, hogy ezekbe a növényekbe olyan géneket kötnek be, amelyeket pl. brazil dióból emeltek ki, amely nagy mennyiséget tartalmaz a kérdéses aminosavakból. Hasonló manipulációkat lehet használni annak érdekében, hogy megemeljék az olaj-, a zsírtartalmat vagy az egyéb tápanyagok mennyiségét.
A GENETIKA BEVETÉSE lényeges javulásokat eredményezett a szarvasmarhák és egyéb állatok hozamában és jólétében. Egyik legújabb, 1993 elején bejelentett példa erre egy olyan disznónak a kifejlesztése, amely nem hordoz magában egy sajátos mutációt, amely egyébként az állat stresszre való érzékenységét fokozza. Mivel ez a hús fokozott soványságát meghatározó tulajdonsággal is kapcsolt, kifejezetten ennek a célnak az érdekében szelektálták ki. A nemkívánatos következmények miatt sikerült ezt a [stressz-] gént a Cotswold Disznótenyésztő Társaság (EK) programjának keretén belül teljesen eltüntetni ("ki-keresztezni").
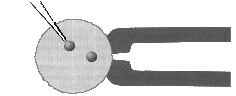
A DNS-t a megtermékenyített petesejt
pronukleuszainak egyikébe fecskendezik
egy finom üvegtű segítségével. Jobboldalt egy pipetta látható, amely a sejtet
tartja.
Most, a hagyományos állatnemesítés kibővült a génsebészettel, transzgénikus állatok létrehozásával. Ha egy gént úgy kell bejuttatni egy szervezetbe, hogy az minden sejtben megtalálható legyen, beleértve az ivarsejteket is, akkor ezt a gént a fejlődés egy rendkívül korai szakaszában kell a szervezetbe vinni. Ezt csakis úgy lehet megtenni, hogy a nőstény állatnak olyan hormonokat adnak, amelyek szupraovulációt (számfeletti ovulációt) váltanak ki: nagy mennyiségű érett petesejtet eredményeznek. Megtermékenyítés után ezeket mikroszkóp alatt rögzítik és klónozott DNS-t fecskendeznek a két sejtmag valamelyikébe. Mindkét sejtmag (egyik a petesejtből, a másik a hímivarsejtből származik), haploid kromoszómakészletet tartalmaz. Az esetek egy részében a befecskendezett DNS egy vagy több kromoszómába beépül. A manipulált ivadék egy nevelőanyába kerül és a megszülető leszármazott szűrhető a bevitt génre.
Egy másik megközelítésben, a DNS-t beültetik az embrió differenciálatlan sejtjeibe (törzs-sejtek), olyan sejtekbe, amelyek beültetés előtti embriókból származnak s amelyek lombikban akadálytalanul tenyészthetők. Azok a sejtek, amelyekben a beültetett DNS "működik" (vagyis termelik az illető fehérjét), lombikban kimutathatók és kiválaszthatók, majd beültethetők egy normális [korai] embrióba és ezek után átvihetők a nevelőanya szervezetébe. A közvetlenül a manipulációt követő nemzedék "kevertsejtű szervezetekből" (kimérákból) áll, mivel a különböző szervekben - beleértve az ivarszerveket (a gonádokat) is - genetikailag megváltoztatott és normális sejtek egyaránt lehetnek. Azonban a leszármazottakban a beültetett [normális és "szerelt"] gének hasadnak, így az ezt követő nemzedékben már megjelenik a teljesen transzgénikus állatok csoportja. Az a lehetőség tehát, hogy a manipulált sejteket lombikokban lehet kezelni, azt jelenti, hogy amennyiben ismert a génszekvencia, a gén a kromoszóma egy adott helyére irányítható ["belőhető"].
A GÉNTERVEZÉS EGYIK CÉLJA, hogy az állatok egészségét javítsuk. Azok a gének, amelyek egy adott betegséggel szembeni ellenállóképességért felelősek, bevihetők egy egyébként védtelen állatba, annak érdekében, hogy megvédjük azt a betegségektől. Egyik példa erre, az álomkórral szembeni természetes ellenállás génjének bevitele bizonyos, erre a betegségre hajlamos szarvasmarhafajtákba. [...]
A másik kitűzhető cél, hogy olyan ritka és drága fehérjéket készítsenek, amelyek az emberi gyógyászatban használatosak. Azok a gének, amelyek ilyen fehérjéket termelnek, például a juhok emlőmirigyeiben működtethetők, a fehérje pedig az állat tejéből nyerhető vissza. Edinburgh-i (EK) kutatók ezt a módszert használták fel arra, hogy a juh a IX-es faktorként ismert véralvadási fehérjét válassza ki tejébe (ennek a fehérjének a hiánya a vérzékenység egy formáját okozza). A megtermékenyített petesejtbe helyezték az új gént, a lactoglobulin génjének ellenőrzési szakasza mellé, amely a juh egyik tejfehérjéjének kiválasztását kódolja.
Egy másik, ilyen módon, a juh révén készített fehérje az -l-antitripszin (ATT). Az emberi szervezet normális módon, maga készíti a saját ATT-jét, ami az elasztin működését ellenőrzi (az enzimét, amely másképpen pl. megtámadná a tüdőszövetet). Az ATT-t olyan betegek igénylik, akik veleszületett tüdőtágulásban [emfizémában] szenvednek, akiknél a saját ATT vagy hibás, vagy pedig teljesen hiányzik.
A legutóbbi időkben végzett kutatások utat nyitottak az emberi genetikai rendellenességek kezelése felé is. Egerek differenciálatlan sejtjeivel dolgozva, Edingburgh-i kutatók olyan sejteket válogattak ki, amelyek a hipoxantin foszforiboziltranszferáz (HPRT) nevű enzim génjében mutációt szenvedtek. Mikor ezeket a sejteket embriókba juttatták be, majd az embriókat nevelőanyákkal kihordatták, azt tapasztalták, hogy a megszülető ivadékok közül néhány, teljesen HPRT-hiányos volt. Ám ez a hiány korrigálható volt azáltal, hogy a még differenciálatlan sejtekbe HPRT enzimet termelő gént juttattak. Ez volt az első bizonyíték arra, hogy egy meghatározott genetikai változtatás vihető be egy emlős csíravonalába. Az emberekben, a HPRT hiánya a súlyos és általában halálos kimenetelű Lesch-Nyhan szindrómában jut kifejezésre. Remények vannak tehát arra nézve, hogy ez a munka olyan módszerek kifejlesztéséhez vezet, amelyek segítségével ez és az ehhez hasonló betegségek kezelhetővé válnak.